高精度データ収集モジュールを使用したフローサイトメーター設計の迅速な実装
DigiKeyの北米担当編集者の提供
2022-04-21
フローサイトメトリーは、細胞の特性を解析する目的で、臨床医や診断医に広く利用されています。細胞1つ1つに対し、タンパク質レベル、血液の健康状態、粒度、細胞の大きさといった属性を光学的に評価します。非常に高感度なシステムでありながら、サイトメーターの設計者は解析時間の短縮を常に迫られているため、フローサイトメトリーと関連エレクトロニクスの両方に新たなアプローチが必要となっています。
サイトメーターは、個々の細胞にレーザー光を照射し、散乱信号や蛍光信号を発生させます。結果として生じる光を素早く正確に捉え、デジタル信号に変換するためには、アバランシェフォトダイオード(APD)と複雑なエレクトロニクスが必要となります。特に、フローサイトメトリーのデータ収集システムでは、システムの精度を確保するために高速かつ低ノイズのデバイスが必要となるため、このプロセスのための回路を設計・実装するには長い時間がかかる可能性があります。
フローサイトメトリー解析の高速化を低コストで実現するために、設計者は内蔵アンプドライバとA/Dコンバータ(ADC)で構成されるデータ収集ソリューションを使用して、速度と精度の問題を解決することができます。
この記事では、フローサイトメトリーシステムの仕組みについて簡単に説明します。その後、Analog Devicesの18ビットADCモジュールであるADAQ23878を紹介し、フローサイトメーターの検出・変換ステージの設計にどのように使用できるかを説明します。また、関連する評価キットも紹介します。
最新のフローサイトメトリーの原理
最新のフローサイトメトリーは、細胞および表面分子を分析し、非均一な細胞集団の異なる細胞タイプを特徴付けて定義する自動プロセスです。これにより、1時間以上かかる調製時間を除けば、1万個の単一細胞に対する3~6個の特性評価を1分以内に行うことができます。
これを実現するには、フローサイトメトリーの単一細胞調製ステップが重要となります。試料の組織化は、シース液中で流体力学的に行われ、細胞や粒子を狭い単一細胞株の試料水流に集束して分析します。この変換において、単一細胞は本来の生物学的特性や生化学成分を維持する必要があります。
図1に示すフローサイトメーター装置では、上部に複数の細胞試料がある状態からスタートします。
 図1:シースフォーカシングからデータ取得までを行うフローサイトメーターの図。(画像提供:Wikipedia、Bonnie Baker氏により一部修正)
図1:シースフォーカシングからデータ取得までを行うフローサイトメーターの図。(画像提供:Wikipedia、Bonnie Baker氏により一部修正)
フローサイトメーターは、フローセル、レーザー、アバランシェフォトダイオード(APD)、トランスインピーダンスアンプ(TIA)、ADC、データ収集/解析用コンピュータという6つの主要コンポーネントで構成されています。
フローサイトメーターは、備えている液体流(シース液)を狭めることで、光ビームを通過させて細胞を運び、1列に並べます。レーザー光は細胞を1つずつ捉え、前方散乱光(FSC)信号と側方散乱光(SSC)信号を作り出します。蛍光灯の光はミラーやフィルタで選別され、APDで増幅されます。
次に、APDに当たった後の光出力を検出し、デジタル化し、解析します。検出時には、Analog DevicesのLTC6268 500MHz超低バイアス電流、低電圧ノイズFET入力オペアンプが、検出に必要な高速TIAにとって理想的です。
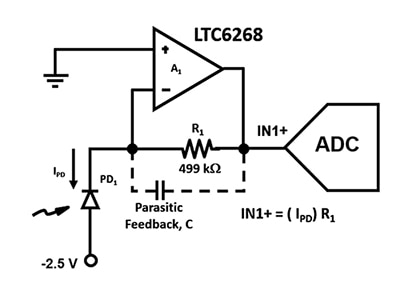 図2:TIA回路は、APD(PD1)と低入力電流FETオペアンプを使用して、超低フォトダイオード電流をIN1+の出力電圧に変換します。(画像提供:Bonnie Baker氏)
図2:TIA回路は、APD(PD1)と低入力電流FETオペアンプを使用して、超低フォトダイオード電流をIN1+の出力電圧に変換します。(画像提供:Bonnie Baker氏)
このアンプ回路をできるだけ広帯域で設計することが極めて重要であり、そのためには寄生容量を最小にする必要があります。たとえば、寄生フィードバック容量Cは、図2に示す回路の安定性と帯域幅に影響を与えます。抵抗器パッケージの選択にかかわらず、アンプのフィードバック経路には常に寄生容量が存在します。しかし、高速アプリケーションには、エンドキャップ間の距離が長く、寄生容量が最も少ない0805パッケージが適しています。
R1のエンドキャップ間の距離を長くすることが、静電容量を低減する唯一の方法ではありません。プレート間の静電容量を低減するもう1つの方法は、抵抗R1の下に追加のグランドトレースを配置し、寄生容量を発生させるEフィールドパスをシールドすることです(図3)。
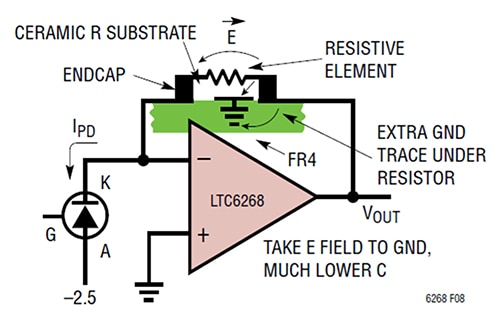 図3:フィードバック抵抗の下にグランドトレースを追加することで、フィードバック側からEフィールドを分岐させ、グランドに放出します。(画像提供:Analog Devices)
図3:フィードバック抵抗の下にグランドトレースを追加することで、フィードバック側からEフィールドを分岐させ、グランドに放出します。(画像提供:Analog Devices)
この場合の具体的な手法には、TIAの出力端付近にある抵抗パッドの下と間に短絡グランドトレースを配置することが含まれます。この技術により、寄生容量値は0.028pF、TIA帯域幅は1/(2π*RF*CPARASITIC)、すなわち11.4MHzとなります。
光信号は、適切な光学フィルタを使用して複数のアバランシェダイオードを指向します。APD、TIA、ADCシステムは、これらの信号をデジタル表現に変換し、さらなる分析のためにマイクロプロセッサにデータを送信します。
最近の機器は通常、複数のレーザーとAPDを搭載しています。現在の商用デバイスは、10個のレーザーと30個のアバランシェフォトダイオードを搭載しています。レーザーと光電子増倍管の検出器数を増やすことで、複数の抗体標識が可能となり、表現型マーカーで目標母集団を正確に特定することができます。
とはいえ、解析の速度は、以下の絶妙なバランスで決まります。
- 流体シースの速度
- 流体力学的集束プロセスによる単一細胞株の形成能力
- トンネルの直径
- 細胞の完全性を維持する能力
- エレクトロニクス
フローサイトメトリーの音響集束
複数のレーザーやAPDを追加することで解析や識別が加速されますが、最新の単一細胞フローサイトメトリーの手法では、せいぜい1分間に100万個の個別細胞のデータを収集するのが精一杯です。血液中に存在する100個/ml程度の循環腫瘍細胞を検出するような多くのアプリケーションでは、これでは不十分です。希少細胞の臨床応用では通常、テストを行うのに数十億個の細胞を分析するための時間が必要となります。
流体力学的に集束された細胞調製プロセスの代替としては、音響集束プロセスがあります。音響集束プロセスでは、チタン酸ジルコン酸鉛(PZT)などの圧電材料をガラス毛細管に貼り付け、電気パルスを機械的振動に変換します(図4a)。PZTを使用してガラス毛細管の側壁を長方形フローセルの共振周波数で振動させることにより、システムは圧力ノードの数が異なるさまざまな音響定在波を生成します。
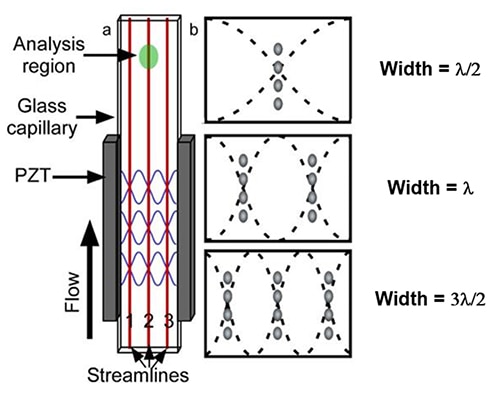 図4:長方形のガラス毛細管で作成された音響フローセルの図(a)。固定幅の毛細管に対する最初の3つの圧力ノードの位置(b)。(画像提供:National Center for Biotechnology Information)
図4:長方形のガラス毛細管で作成された音響フローセルの図(a)。固定幅の毛細管に対する最初の3つの圧力ノードの位置(b)。(画像提供:National Center for Biotechnology Information)
これらのPZT周波数ノードが、流れる粒子を複数の個別の流線に整列させます(図4b)。音響フローセルは、線形の定在音響波を使用して、単一または複数の高調波を発生させることで、さまざまな波長に対応します。単純な線形定在波モデルで予測されるように、試料中の細胞は、フローチャンバー内で1つまたは多数の単一細胞株を生成します。
このように細胞を正確に組織化することで、フローシーストンネルの幅を広げ、レーザービームを通過する流速を加速させることが可能になります(図5)。
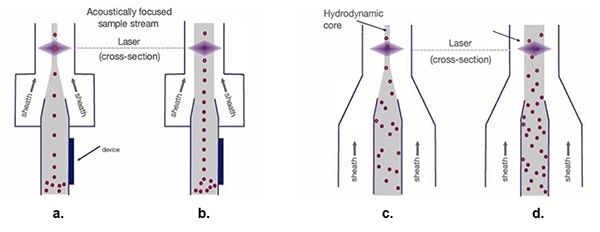 図5:流体力学的な試料水流(c.とd.)を使用した場合、シース幅が大きくなると細胞試料が散乱し、光学的測定プロセスが困難になります。音響的に集束された試料水流(a.とb.) は、シース幅に関係なく、1列に並んだ細胞を維持します。(画像提供:Thermo Fischer Scientific)
図5:流体力学的な試料水流(c.とd.)を使用した場合、シース幅が大きくなると細胞試料が散乱し、光学的測定プロセスが困難になります。音響的に集束された試料水流(a.とb.) は、シース幅に関係なく、1列に並んだ細胞を維持します。(画像提供:Thermo Fischer Scientific)
従来の流体力学的集束(図5c.)では、レーザースキャンに備えて、単一細胞株を配列します。試料水流のコアの通路を広くすると、シース材料の速度を上げることができますが(図5d.)、その結果、単一細胞の組織が広がり、信号の変化やデータ品質の低下が生じます。
音響集束(図5a.)は、トンネル幅が広くても、生体細胞やその他の粒子をしっかりと位置調整します。この正確な細胞整列により、データ品質を維持したまま、より高いサンプルレートを実現できます(図5b.)。
実際には、フローサイトメトリーの音響集束により、細胞のサンプリング回数が20倍程度まで増加します(図6)。
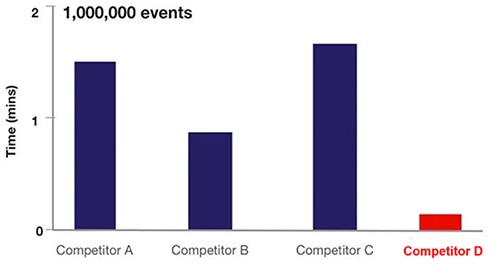 図6:流体フローサイトメトリー(A、B、C)と音響集束サイトメトリー(D)をベースとした各種フローサイトメトリー装置におけるサンプリング時間の比較。(画像提供:Thermo Fischer Scientific)
図6:流体フローサイトメトリー(A、B、C)と音響集束サイトメトリー(D)をベースとした各種フローサイトメトリー装置におけるサンプリング時間の比較。(画像提供:Thermo Fischer Scientific)
図6において、A、B、Cの装置は流体力学的技術を、Dの装置は音響集束サイトメトリーフローのアプローチを採用しています。
音響集束フローサイトメトリーのデータ収集
音響集束フローサイトメトリー装置のエレクトロニクス設計では、大口径ノズルを通過する血液細胞やシース液の速度に対応するため、高速の受光電子回路が必要となります。前述した600MHzの高速LTC6268と専用の0805抵抗パッケージレイアウトを組み合わせることで、光センシング速度は11.4MHzまで向上します(図7、左)。LTC6268の出力は、Analog DevicesのADAQ23878 ADCに供給され、デジタル化されます。
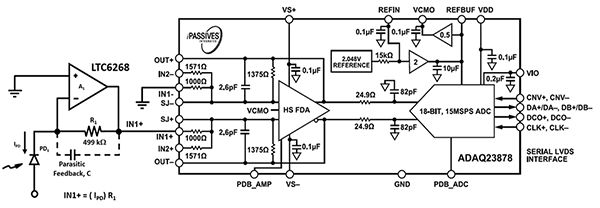 図7:ADAQ23878 ADCは、フォトダイオード(PD1)とTIA回路(左)からの光信号をデジタル化します。(画像提供:Bonnie Baker氏)
図7:ADAQ23878 ADCは、フォトダイオード(PD1)とTIA回路(左)からの光信号をデジタル化します。(画像提供:Bonnie Baker氏)
ADAQ23878は、18ビット、15メガサンプル/秒(MSPS)、高精度、高速のシステムインパッケージ(SIP)データ収集ソリューションです。この製品により、入力ドライバ部品の選択、最適化、レイアウトなどの設計負担を設計者からデバイスに移すことができるため、高精度測定システムの開発サイクルを大幅に短縮することが可能になります。
SIPのモジュラーアプローチにより、複数の共通信号処理と調整ブロックおよび、高速18ビット、15MSPSの逐次比較レジスタ(SAR)ADCを単一デバイスにまとめ、エンドシステムの部品点数を削減できます。これらのブロックには、低ノイズの完全差動ADCドライバアンプおよび、安定したリファレンスバッファが含まれます。
また、ADAQ23878には、Analog DevicesのiPassive技術を採用した重要な受動部品が組み込まれているため、温度依存の誤差原因を最小限に抑え、性能を最適化できます。ADCドライバ段の高速セトリングは、確実な高速データ収集に貢献します。
ADAQ23878 µModuleの評価
ADAQ23878を評価するために、Analog DevicesはEVAL-ADAQ23878FMCZ評価ボードを提供しています(図8)。このボードは、ADAQ23878 μModuleの性能を実証し、フローサイトメトリーのフロントエンド設計の評価および、その他さまざまなアプリケーションに対応できる汎用性の高いツールです。
 図8: ADAQ23878用のEVAL-ADAQ23878FMCZ評価ボードは、電源回路を搭載し、制御やデータ解析のための関連ソフトウェアを備え、SDP-H1に対応します。(画像提供:Analog Devices)
図8: ADAQ23878用のEVAL-ADAQ23878FMCZ評価ボードは、電源回路を搭載し、制御やデータ解析のための関連ソフトウェアを備え、SDP-H1に対応します。(画像提供:Analog Devices)
EVAL-ADAQ23878FMCZ評価ボードには、Windows 10以上を実行できるパソコン、低ノイズの精密信号源および、18ビットテストに適したバンドパスフィルタが必要です。また、ADAQ23878 ACEプラグインとSPD-H1ドライバも必要となります。
まとめ
標準的な流体力学的集束フローサイトメトリー技術を用いて生体細胞を1個ずつ検査することは成功してきましたが、より高速な分析の必要性に伴い、音響集束フロー方式に基づく技術への移行が進んでいます。とはいえ、より高度なフローサイトメトリーをサポートするエレクトロニクスも、スペース、コスト、開発期間を最小限に抑えながら、向上させていく必要があります。
この記事で説明したように、LTC6268高速オペアンプとADAQ233878高精度高速μModuleデータ収集ソリューションを組み合わせることで、高度なフローサイトメトリー装置のための完全なデータ収集システムを構築できます。

免責条項:このウェブサイト上で、さまざまな著者および/またはフォーラム参加者によって表明された意見、信念や視点は、DigiKeyの意見、信念および視点またはDigiKeyの公式な方針を必ずしも反映するものではありません。





